Come cresce un muscolo


Un muscolo può crescere in due modi: o aumenta il volume delle cellule o aumenta il numero delle cellule. La prima si chiama ipertrofia, e la conoscono tutti. La seconda è più complessa.
Alcuni credono si chiami iperplasia, ma in realtà nessuna ricerca ha ancora dimostrato che questa sia possibile nell’uomo. Nell’animale invece sì (1, 2, 3, 4). E ci sono delle prove a sostegno di questa tesi. Per spiegarlo bisogna partire dal tessuto non muscolare, ma adiposo.
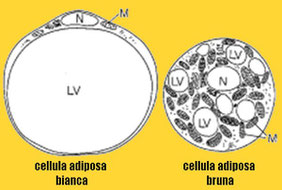
Noi abbiamo due tipi di tessuto adiposo: bianco e bruno (ce ne sarebbe anche un terzo, grigio, ma in questa sede lasciamo stare).
Il bianco è povero di mitocondri, il bruno ne è ricco (sono quegli elementi scuri nell'immagine). E nei mitocondri ci sono delle particolari proteine che si chiamano UCP-1.
Le UCP-1 sono responsabili della termogenesi, cioè della produzione di calore. Infatti il tessuto adiposo bruno è quello deputato allo sviluppo di calore. Gli animali che vanno in letargo ne sono particolarmente ricchi, perché devono mantenere alta la temperatura corporea evitando così di morire di freddo.

L’uomo adulto ha generalmente poco tessuto adiposo bruno, e per produrre calore deve ricorrere al movimento (gli stessi brividi di freddo hanno questa finalità). Gli animali ne hanno di più, ma non tutte le specie. Gli orsi per esempio ne sono ricchi, e infatti vanno tranquillamente in letargo per sei mesi.
Al contrario gli uccelli ne sono privi, e questo sarebbe stato un problema soprattutto per i loro piccoli
perché nelle ere glaciali si sarebbero estinti. Per mantenere una temperatura corporea adeguata e poter sopravvivere, l’evoluzione ha fatto sì che in questa specie si realizzasse una specie di
miracolo: l’aumento della massa muscolare.
Non per ipertrofia, ma proprio per quella iperplasia di cui si parlava sopra. Di alcuni distretti in maniera particolare: a seconda che un uccello sia stato un corridore (es. struzzi) oppure un nuotatore (es. pinguini), si è avuta iperplasia dei muscoli delle cosce, del torace o di entrambi.


Gli uccelli che invece non hanno potuto contare su questo processo di iperplasia presentano aumento della frequenza cardiaca (260 battiti al minuto nel piccione, 570 nel pettirosso) e ipercinesi (tremore) nel muscolo scheletrico. In questo modo riescono a mantenere temperature alte (42° C nel canarino, che infatti in gabbia non sta mai fermo).
Fatta questa premessa, veniamo alla crescita muscolare dell’uomo che fa palestra. L’ipertrofia abbiamo detto che è una delle vie. Ma non sempre è la causa della crescita. Biopsie effettuate sui body builder hanno trovato fibre addirittura più piccole (5), non più grandi, quindi non ipertrofiche (ciò non toglie comunque che l’ipertrofia è possibile). Ma è stato riscontrato un numero maggiore di fibre (6, 7) e con pochi mitocondri (tenete a mente questo particolare dei mitocondri). Però abbiamo detto che sull’iperplasia non ci sono studi che ne confermino l’esistenza. Nemmeno sotto doping (8).

Cosa è allora se non è ipertrofia e non è iperplasia? Si tratta dello sviluppo delle cellule satelliti (9).
Quegli elementi che risiedono sulla membrana muscolare, pronti ad attivarsi se arriva lo stimolo giusto. Vi dicevo di tenere a mente i pochi mitocondri riscontrati nelle biopsie dei culturisti perché queste cellule satelliti hanno infatti un ridotto contenuto in organuli cellulari, mitocondri compresi.
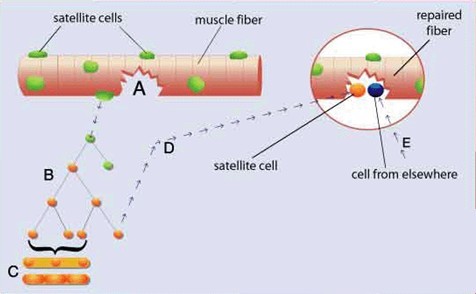
Lo “stimolo giusto” per queste cellule è il danno muscolare indotto dall’esercizio. Allora le cellule si dividono e rigenerano il muscolo. Fondendosi tra loro e con le miofibrille esistenti nella struttura della lamina basale, vanno a determinare la crescita muscolare. Non sono le cellule muscolari a proliferare, ma le satelliti. Né ipertrofia né iperplasia, dunque, ma MIOGENESI.
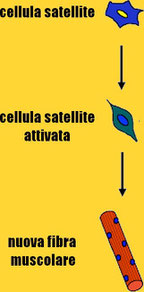
Dopo varie divisioni, le cellule non impiegate nel processo ritornano allo stato quiesciente a formare un pool di riserva. E questo è fondamentale perché altrimenti ripeti cicli di rigenerazioni muscolari porterebbero rapidamente a deplezione del pool di cellule satelliti.
Il periodo conseguente all’insulto è caratterizzato da due fasi: degenerativa e rigenerativa, ognuna a sua volta divisa in due fasi.
PRIMA FASE DEGENERATIVA: distruzione del sarcolemma, con aumento del CK (10), indicatore di danno muscolare (infatti le analisi non vanno fatte il giorno dopo essersi allenati altrimenti troveremo il CK, oltre che le transaminasi, elevatissimo).
SECONDA FASE DEGENERATIVA: necrosi del tessuto danneggiato e attivazione di una risposta antinfiammatoria (11).
PRIMA FASE RIGENERATIVA: attivazione delle cellule miogeniche (12, 13, 14).
SECONDA FASE RIGENERATIVA: ritorno allo stato quiesciente delle cellule satelliti non utilizzate a formare il pool di riserva” (15).
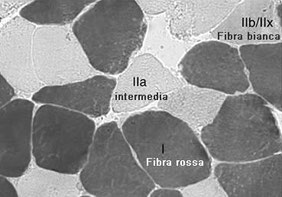
A questo punto, le nuove fibre saranno fibre intermedie, embrionali e perciò totipotenti; quindi verranno influenzate dal tipo di stimolo allenante (anche se più spesso finiscono per somigliare alle fibre prevalenti del gruppo muscolare in cui si trovano).
Dopo tutta questa lunga premessa siamo arrivati finalmente al punto fondamentale: come stimolare le cellule satelliti?

Intanto la dieta. L’alimentazione deve essere IPERCALORICA per mantenere un adeguato livello di grasso: 10-12%, la percentuale con cui i culturisti hanno sempre fatto “massa”. Questo perché le cellule satelliti sono anche sul tessuto adiposo e con lo stimolo allenante possono attivarsi in senso miogenico, quindi in direzione muscolare (la stessa cosa avviene al contrario: in assenza di allenamento le cellule muscolari si attivano in senso adipogenico, cioè diventano grasso; e in quel caso si tratta di grasso pericoloso perché di tipo bianco e non bruno).
La supplementazione di creatina, in associazione con un aumento dei carichi, porta a un aumento dell’attività delle cellule satelliti (16).

L’allenamento deve essere misto. Grossi carichi, ripetizioni medio-basse (6-8) ed esecuzione esplosiva, con accentuazione della fase negativa, per sfruttare l’abbinamento con la creatina. Alte ripetizioni, carichi medio-bassi e recuperi brevi, perché il maggior numero di cellule satelliti sembra risiedere nelle vicinanze delle fibre rosse (17, 18, 19, 20).
L’importante è l’accentuazione della fase negativa. Gli esercizi eccentrici inducono il danno al muscolo necessario (21, 22, 23). Va ricercato lo “strappo” muscolare, le microlesioni da cui fuoriusciranno i fattori di crescita che andranno a stimolare le cellule satelliti.
Infine adeguato recupero tra una sessione e l’altra: secondo alcuni studi, il tempo di ritorno al muscolo normale dopo il danno da esercizio si ha tra i 6 giorni e le 3-4 settimane (10).

Le cellule satelliti sono il motivo per il quale una certa quantità di muscolo continua a permanere anche a sospensione dell’allenamento. Ad esempio, se ci si è allenati bene durante l’inverno, a seguito di sospensione dell’attività per l’estate, il muscolo va incontro a ipotrofia, ma il numero di cellule rimane invariato (24).
E alla ripresa degli allenamenti il muscolo ritornerà abbastanza velocemente ai suoi standard. È una cosa che sperimentano tutti. Tant’è che si parlava di “memoria muscolare”, ma il muscolo non ha cervello. Ha però le cellule satelliti, che sono state attivate dagli allenamenti intensi e hanno formato nuova massa muscolare. Massa che sarà duratura, non andrà più via, potrà ridursi di volume ma sarà sempre presente, per cui appena si ritoccheranno i pesi si riacquisterà rapidamente tono e volume.
BIBLIOGRAFIA
- Gonyea WJ, Antonio J, Skeletal muscle hyperplasia, Med Sci Sports Exerc, 25, 1233, 1993.
- Antonio J, Gonyea WJ, Muscle fiber splitting in stretch-enlarged avian muscle, Med Sci Sports Exerc, 26 (8), 973-977, 1994.
- Gonyea W, Ericson GC, Bonde-Petersen F, Skeletal muscle fiber splitting induced by weight-lifting exercise in cats, Acta Physiol Scand, 99 (1), 105-9, 1977.
- Ho KW et al, Skeletal muscle fiber splitting with weight-lifting exercise in rats, Am. J. Anat., 157, 433, 1980.
- Tesch PA, Larsson L, Muscle hypertrophy in bodybuilders, Eur J Appl Physiol Occup Physiol, 49 (3), 301-6, 1982.
- Larsson L, Tesch PA, Motor unit fibre density in extremely hypertrophied skeletal muscles in man. Electrophysiological signs of muscle fibre hyperplasia, Eur J Appl Physiol Occup Physiol, 55 (2), 130-6, 1986.
- MacDougall JD, Sale DG, Elder GC, Sutton JR, Muscle ultrastructural characteristics of elite powerlifters and bodybuilders, Eur J Appl Physiol Occup Physiol, 48 (1), 117-26, 1982.
- Fontana K et al, Morphological changes in murine skeletal muscle in response to exercise and mesterolone, J Electron Microsc, 59 (2), 153-6, 2010.
- Mauro A, Satellite cells of skeletal muscle fibres, J Biophys Biochem Cytol, 9, 493–495, 1961.
- Chargé SBP, Rudnicki MA, Cellular and Molecular Regulation of Muscle Regeneration, Physiol Rev, 84, 209-238, 2004.
- Merly F, Lescaudron L, Rouaud T, Crossin F, Gardahaut MF, Macrophages enhance muscle satellite cell proliferation and delay their differentiation, Muscle Nerve, 22, 724-732, 1999.
- Darr KC, Schultz E., Exercise-induced satellite cell activation in growing and mature skeletal muscle, J Appl Physiol, 63, 1816-1821, 1987.
- Snow M.H., Myogenic cell formation in regenerating rat skeletal muscle injured by mincing. II. An autoradiographic study, Anat Rec, 188, 201-217, 1977.
- Snow MH, An autoradiographic study of satellite cell differentiation into regenerating myotubes following transplantation of muscles in young rats, Cell Tissue Res, 186, 535-540, 1978.
- Schultz E, Satellite cell proliferative compartments in growing skeletal muscles, Dev Biol, 175, 84-94, 1996.
- Dangott B, Schultz E, Mozdziak PE, Dietary creatine monohydrate supplementation increases satellite cell mitotic activity during compensatory hypertrophy, Int J Sports Med, 21 (1), 13-16, 2000.
-
Gibson MC, Schultz E, The distribution of satellite cells and their relationship to specific fiber types in
soleus and extensor digitorum longus muscles, Anat Rec, 202, 329-337, 1982.
- Rosenblatt JD, Lunt AI, Parry DJ, Partridge TA, Culturing satellite cells from living single muscle fiber explants in Vitro, Cell Dev Biol, 31, 773-779, 1995.
- Schmalbruch H, Hellhammer U, The number of nuclei in adult rat muscles with special reference to satellite cells, Anat Rec, 189, 169-175, 1977.
- Snow MH, A quantitative ultrastructure analysis of satellite cells in denervated fast and slow muscles of the mouse, Anat Rec, 207, 593-604, 1983.
- Irintchev A, Wernig A, Muscle damage and repair in voluntarily running mice: strain and muscle differences, Cell Tissue Res, 249, 509-521, 1987.
- Faulkner JA, Brooks SV, Opiteck JA, Injury to skeletal muscle fibers during contractions: conditions of occurrence and prevention, Phys Ther, 73, 911-921, 1993.
- Armstrong RB, Warren G.L., Warren J.A., Mechanisms of exercise-induced muscle fibre injury, Sports Med, 12, 184-207, 1991.
-
Musacchia XJ, Steffen JM, Fell RD, Dombrowski MJ, Comparative morphometry of fibers and capillaries in
soleus following weightlessness (SL-3) and suspension, Physiologist, 31(1 Suppl), S28-29, 1988.









Scrivi commento